química
Química (palabra que podría provenir de los términos griegos χημία o χημεία, quemia y quemeia respectivamente) es la química que estudia tanto la composición, estructura y propiedades de la materia como los cambios que ésta experimenta durante las radiactividad y su relación con la energía Es definida, en tanto, por LINUS PAULING como la ciencia que estudia las sustancias su estructura (tipos y formas de acomodo de los átomos ,sus propiedades y las reacciones que las transforman en otras sustancias.
La química moderna se desarrolló a partir de la alquimia , una práctica protocientifica de carácter filosófico, que combinaba elementos de la química, la metalurgia , la física, la medicina , la biología, entre otras ciencias y artes. Esta fase termina al ocurrir la llamada, revolución de la química , basada en la ley de conservación y la teoría de la combustión por oxigeno postuladas por el científico francés, Antoine lavosier
Las disciplinas de la química se agrupan según la clase de materia bajo estudio o el tipo de estudio realizado. Entre éstas se tienen la química inorgánica, que estudia la materia inorgánica; la química orgánica, que estudia la materia orgánica; la bioquímica , que estudia las substancias existentes en organismos biológicos; la físico química , que comprende los aspectos energéticos de sistemas químicos a escalas microscópicas, moleculares y atómicas, o la química analítica que analiza muestras de materia y trata de entender su composición y estructura
química que nos rodea
A lo largo de toda nuestra vida, al igual que el resto de seres vivos de nuestro planeta, interaccionamos en nuestro entorno con miles de sustancias exógenas. Es decir, no hay absolutamente nada que esté fuera del alcance de éstos, ¡nadie ni nada se libra! Muchas de estas sustancias son absorbidas por nuestro organismo y se clasifican en dos grandes grupos:
Sustancias con función biológica: éstas tienen una función endógena en el organismo, como por ejemplo: los nutrientes, las vitaminas, oligoelementos, etc.
Sustancias sin función biológica: éstas no poseen una función endógena en el organismo y se denominan xenobióticos.
¿Qué es un xenobiótico?
“Es toda aquella sustancia ajena al organismo que no posee una función biológica endógena”. Aproximadamente estamos expuestos a más de 10.000 moléculas que tienen diferentes efectos tóxicos sobre nuestro organismo. Ahora entraremos un poco en detalle para explicar algunas características sobre ellos.
¿Todos los xenobióticos son malos?
La respuesta es no. Algunos de ellos cuando se suministran a una dosis baja pueden causar alteraciones deseadas para compensar o remediar estados de enfermedad, es decir tienen efectos terapéuticos. Exacto: son los medicamentos. Pero cuando la dosis es alta y el organismo no puede eliminarlos rápidamente se convierten en un problema para la salud, creando un efecto tóxico.
Por ejemplo, un medicamento como es el ácido acetilsalicílico para el dolor de cabeza, puede repercutir negativamente sobre la salud si se toma de forma accidental (sin receta médica) o suicida, ya que el órgano que se encarga de eliminarlo en el organismo puede verse afectado, nuestro querido hígado.
¿Qué características tienen?
Para poder observar ese efecto tóxico, primero esta molécula debe entrar en el organismo y hay diferentes vías: respiratoria, dérmica, digestiva o parenteral. Como podéis ver en la imagen. Hay que destacar que hay mayor efecto cuando entra directamente a la sangre.
Después esta sustancia llegará a una determinada parte del organismo y se acumule. Al principio no ocurrirá nada, pero cuando se acumule durante un tiempo habrá una concentración elevada del tóxico, pudiendo provocar problemas. Hay muchos factores que influyen en esto:
Características químicas y físicas.
Vía de entrada.
La interacción de la molécula con el organismo.
La sensibilidad del individuo.
Después esta sustancia llegará a una determinada parte del organismo y se acumule. Al principio no ocurrirá nada, pero cuando se acumule durante un tiempo habrá una concentración elevada del tóxico, pudiendo provocar problemas. Hay muchos factores que influyen en esto:
Características químicas y físicas.
Vía de entrada.
La interacción de la molécula con el organismo.
La sensibilidad del individuo.
LA QUÍMICA
beneficios y perjuicios
Beneficios :
la medicina nueva es decir los nuevos medicamentos ,las vacunas la nueva industria
perjuicios:
Es todo material nocivo o perjudicial, que durante su fabricación, almacenamiento, transporte o uso, puede generar o desprender humos, gases, vapores, polvos o fibras de naturaleza peligrosa, ya sea explosiva, inflamable, tóxica, infecciosa, radiactiva, corrosiva o irritante en cantidad que tengan probabilidad de causar lesiones químicas y daños a personas, instalaciones o medio ambiente
bombas atómicas o nucleares
creación de nuevas enfermedades
creación de sustancias nocivas para el medio ambiente como insecticidaz aromantizantez etc
no buen uso por parte de las industrias


La química en el medio ambiente
método científico

ejemplos de método científico
a) Observación: Una
manzana cayó de un árbol.
¿Porqué los
objetos caen?
b ) Hipótesis: Debe haber
algo que lo atraiga hacia el centro de la Tierra
c ) Experimentación:
"Lanzaré una piedra, una pluma, una hoja y un zapato repetidas
veces, para analizar qué
sucede".
d) Conclusión: “A mayor
masa, mayor es la velocidad con la que los objetos caen".
Materia
Materia es todo aquello que tiene un lugar en el espacio, posee una cierta cantidad de energía y está sujeto a cambios con el tiempo y a interacciones con aparatos de medida. En física y filosofía , materia es el término para referirse a los constituyentes de la realidad material , entendiendo por objetiva que pueda ser percibida de la misma forma por diversos sujetos. Se considera que es lo que forma la parte sensible de lo objetos perceptibles o detectables por medios físicos. Es decir es todo aquello que ocupa un sitio en el espacio, se puede tocar, se puede sentir, se puede medir, etc.
Es todo lo que posee masa y ocupa un lugar en el espacio.
Los cambios que la materia sufre involucra ganancia o pérdida de energía.
energía y cuerpo
energía : Es la capacidad para hacer un trabajo.
Como muchos otros mamíferos, los seres humanos somos seres homeotermos; es decir, para que nuestro cuerpo funcione correctamente necesitamos mantener una temperatura interna constante, cercana a los 37 grados Celsius. Con esta temperatura, podemos mantener el corazón funcionando, los músculos en alerta, el sistema nervioso funcionando, los intestinos moviéndose... Para mantener toda esta actividad, obtenemos nuestra energía sólo delos alimentos. De acuerdo a la cadena alimentaria, la especie humana obtiene los nutrientes y la energía a partir de plantas y animales.
La energía va desde el alimento a nuestro cuerpo, para desarrollar diversas funciones mediante transformaciones de la energía. Tomemos, por ejemplo, un pan. El pan está hecho de trigo, el cual posee fundamentalmente carbohidratos, o energía química almacenada. Cuando te comes el pan, tu cuerpo adquiere esa energía. Luego, puede almacenarla, o utilizarla de inmediato para moverse, para mantener la temperatura, para hacer funcionar el sistema nervioso. Así,el organismo transforma la energía química de los alimentos en energía mecánica (movimiento), energía térmica (calor) y energía eléctrica (transmisión de impulsos nerviosos).
Ejemplos: El agua, El amoniaco, el azúcar (sacarosa), el oro, y el oxigeno.
Las sustancias difieren entre si en su composición y pueden identificarse por su apariencia, olor, sabor y otras propiedades.
Mezclas

CLASIFICACIÓN DE LA MATERIA: SUSTANCIAS PURAS
Elemento, son sustancias simples que no se descomponen por medios químicos. Ej. Au (Oro)

Compuesto, son sustancias que están formadas por dos o más elementos y pueden descomponerse por medios químicos. Ej. NaCl (Sal)


Una mezcla está formado por dos o más sustancias, por ejemplo H2O más NaCl (dos sustancias); por tanto se caracteriza por tener composición variable, pueden separarse por medios físicos y su temperatura es variable durante el cambio de estado. Se puede dividir en mezclas homogéneas y heterogéneas
EJERCICIO
CLASIFICA ENTRE SUSTANCIA PURA, MEZCLA HOMOGÉNEA Y MEZCLA HETEROGÉNEA
1.AIRE
2.PERFUME
3.OXÍGENO EN UN TANQUE DE OXÍGENO DE UN HOSPITAL
4.YODO
5.AZÚCAR
6.TIERRA Y AGUA
7.CAFÉ CON LECHE
8.PAPEL Y ASERRÍN
9.CLORO
10.PIEDRAS Y ARENA
respuestas:
1 mezcla homogénea
2 homogénea
3 homogénea
4 sustancia pura
5 homogénea
6 heterogénea
7 homogénea
8 heterogénea
9 sustancia pura
10 heterogénea
SISTEMA MATERIAL
Un sistema material es un elemento o conjuntos de elementos que se aísla imaginariamente para facilitar su estudio, por Ej.
*Recipiente con sal disuelta en agua
*Mezcla de agua y alcohol
*Recipiente con hielo y agua
Los sistemas están formados por fases, si son homogéneos por una sola fase, si son heterogéneos pueden tener dos, tres, cuatro o múltiples fases.
Ejemplos de mezclas :

PROPIEDADES DE LA MATERIA
PROPIEDADES ORGANOLÉPTICAS
COLOR: Se puede distinguir por: Transparencia, la luz atraviesa la sustancia y llega así a nuestros ojos. Reflexión, la luz incide lateralmente y recién entonces nos impresiona. Ej. Cuando vemos a través de vidrio vemos por transparencia.

Cuando vemos la superficie de un mueble lo vemos por reflexión




ROPIEDADES INTENSIVAS Y EXTENSIVAS
No dependen de la cantidad de la materia, color, dureza, densidad, punto de fusión, etc.
*Propiedades Extensivas:
Dependen de la cantidad de materia, volumen, peso , longitud, etc.

PROPIEDADES FÍSICAS
Son aquellas que se pueden determinar sin alterar la identidad de la sustancia. Pueden ser generales o particulares.Estas propiedades pueden variar en tres estados distintos como: Estado Sólido, Líquido y Gaseoso.

Inercia Elasticidad
Impenetrabilidad
Discontinuidad
Indestructibilidad
Divisibilidad
Propiedades Físicas particulares son las que identifican realmente a cada sustancia y son:
Propiedades Físicas particulares son las que identifican realmente a cada sustancia y son:
Densidad Dureza
propiedad específica de la materia que nos permite diferenciar unos materiales de otros.
Mide, en cierto modo, lo concentrada que esta la masa de un cuerpo. Por ejemplo, el plomo tiene la densidad mayor que la madera.
La densidad es la relación que existe entre la masa y el volumen de un cuerpo.
Densidad = masa / volumen
propiedad específica de la materia que nos permite diferenciar unos materiales de otros.
Mide, en cierto modo, lo concentrada que esta la masa de un cuerpo. Por ejemplo, el plomo tiene la densidad mayor que la madera.
La densidad es la relación que existe entre la masa y el volumen de un cuerpo.
Densidad = masa / volumen
Maleabilidad
Ductilidad
La ductilidad es una propiedad que presentan algunos materiales, como las aleaciones metálicas o materiales asfálticos, los cuales bajo la acción de una fuerza, pueden deformarse sostenible mente sin romperse, permitiendo obtener alambres o hilos de dicho material. A los materiales que presentan esta propiedad se les denomina dúctiles. Los materiales no dúctiles se califican como frágiles. Aunque los materiales dúctiles también pueden llegar a romperse bajo el esfuerzo adecuado, esta rotura sólo sucede tras producirse grandes deformaciones.
Viscosidad
La viscosidad es la oposición de un fluido a las deformaciones tangenciales, es debida a las fuerzas de cohesión moleculares. Todos los fluidos conocidos presentan algo de viscosidad, siendo el modelo de viscosidad nula una aproximación bastante buena para ciertas aplicaciones. Un fluido que no tiene viscosidad se llama fluido idealINERCIA: Es la propiedad por la que todos los cuerpos tienden a mantenerse en su estado de reposo o movimiento.

•IMPENETRABILIDAD: Es la imposibilidad de que dos cuerpos distintos ocupen el mismo espacio simultáneamente. Es la resistencia que pone un cuerpo a ser traspasado. Ej. En un recipiente de 20 lts solo se puede colocar 20 lts de líquido, si se quiere colocar más este no cabe.



INDESTRUCTIBILIDAD: Propiedad que tienen los cuerpos de ser indestructibles – Ley de Lavoisier. Ej. El Tungsteno, El Oro


DENSIDAD: Cantidad de masa ejercida por un volumen dado de un material. Usualmente expresada en libras por pie cúbico (lb/ft3) o gramos por centímetro cúbico (g/cm3).En el caso de los gases, la densidad es afectada de manera importante por la temperatura y la presión. Cuando hablamos de sólidos y líquidos el punto de referencia es la densidad del agua. Cuando hablamos de la densidad de los gases el punto de referencia es la densidad del aire. Es la cantidad de masa por la unidad de volumen





PROPIEDADES QUÍMICAS
•Sufren alteración en su estructura interna o molecular cuando actúan con otras sustancias. Ejemplo: El sodio reacciona violentamente con el agua fría para formar Hidróxido de sodio mientras que el Calcio reacciona muy lentamente con el agua para formar Hidróxido de Calcio


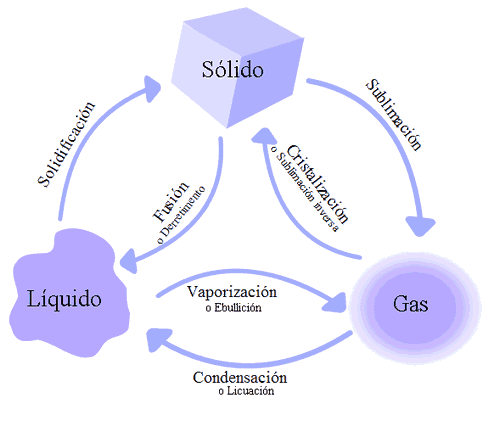
ESTADO SÓLIDO
Las fuerzas de cohesión de sus moléculas son mayores que las fuerzas de repulsión, sus cuerpos son compactos, presentan volumen y forma definida. Ej. Hierro, aluminio, azúcar

EJEMPLO CAMBIOS FÍSICOS Y QUÍMICOS
Una hoja de libro puede ser separada del libro y cambiada de lugar, puede ser cortada en tres pedazos y puede ser quemada con la ayuda de un fósforo.
Se puede observar en los dos primeros casos, la sustancia papel, no cambia, sigue siendo papel, pero en el tercero el papel, desaparece y se transforma en cenizas, gas, etc. Se puede establecer con este ejemplo que un fenómeno físico es aquel cambio que se produce sobra la materia sin modificar su composición, en cambio fenómeno químico es el cambio que ocurre en una porción de la materia y altera su composición.

Las fuerzas de cohesión de sus moléculas son mayores que las fuerzas de repulsión, sus cuerpos son compactos, presentan volumen y forma definida. Ej. Hierro, aluminio, azúcar
Las fuerzas de cohesión son similares a las fuerzas de dispersión, presentan un volumen definido, su forma es variable (de acuerdo al recipiente que lo contiene) Ej. Agua oxigenada.
Las fuerzas de dispersión o expansión son mayores que las fuerzas de atracción en las moléculas de los gases, por lo tanto no tienen volumen ni forma definida. Ej. Aire, oxígeno.



ENERGÍA
*La energía es una propiedad asociada a los objetos y sustancias y se manifiesta en las transformaciones que ocurren en la naturaleza.
*La energía se manifiesta en los cambios físicos, por ejemplo, al elevar un objeto, transportarlo, reformarlo o calentarlo.
*La energía está presente también en los cambios químicos, como al quemar un trozo de madera o en la descomposición de agua mediante la corriente eléctrica.


TIPOS DE ENERGÍA


"En toda reacción química la masa se conserva, esto es, la masa total de los reactivos es igual a la masa total de los productos"
Así, por ejemplo, cuando se hacen reaccionar 7 g de hierro con 4 g de azufre se obtienen 11 g de sulfuro de hierro:

Si analizamos el ejemplo del funcionamiento de un automóvil, nos daremos cuenta como la energía va sufriendo cambios, es decir, se va transformando. Al introducir la llave en el switch y girarla (energía mecánica) cerramos el circuito que activa la energía de la batería (energía química), produciéndose una corriente eléctrica (energía eléctrica) que alimenta al motor de arranque y a las bujías, en estas se produce la chispa que provoca la ignición de la gasolina comprimida en los cilindros (energía química), originando la explosión que provoca el movimiento del cigüeñal (energía mecánica) que hace que el automóvil se mueva. Además de este tipo de conversiones de la energía, pueden existir otros mas. Lo importante de esto es que la energía involucrada en cualquier proceso siempre se conserva manifestándose de alguna forma durante o después de llevado a cabo el proceso del que se trate. Este hecho se expresa en la ley de la conservación de la energía, que dice: * La energía no se crea ni se destruye, solo se transforma.

UNIDADES: SISTEMA INTERNACIONAL


DENSIDAD DE UN MATERIAL
Las diferentes partículas que existen en la naturaleza están conformadas por partículas (átomos, iones o moléculas) que según las condiciones de presión y temperatura a las que se encuentran definirán el estado de la materia (sólido, liquido o gaseoso) y una condición muy característica.
Para caracterizar el estado tan singular de la sustancia, se emplea la propiedad física intensiva denominada densidad (ρ), que nos indicara la cantidad de masa del cuerpo material contenido en un volumen definido de ella.
Por lo tanto la masa y el volumen de una sustancia la podemos evaluar así:
masa: m = ρ . V
Volumen: V = m / ρ Unidades: Las unidades en la que puede estar la densidad son

¿Cuál es la densidad de un material, si 30 cm cúbicos tiene una masa de 600 gr?
Solución: Sabemos que
De los datos del problema sabemos que:
m = 600 gr.
V = 30 cm3
Entonces reemplazando en la formula:
ρ = m / V
ρ = 600 gr / 30 cm3
ρ = 20 gr / cm3

UNIDADES DE MEDIDA TEMPERATURA
ESCALAS DE TEMPERATURA
•Escalas Relativas: Consideran como referencia el punto de ebullición y solidificación de una sustancia o mezcla.
Escala Celsius o Centígrado: Toma como compuesto de referencia el agua: punto de ebullición 100 ° C y punto de solidificación 0 °C. El nombre se debe al físico Andrés Celsius que la propuso en 1742
Escala Fahrenheit: Toma como referencia el punto de congelamiento de una solución amoniacal 0 °F. La temperatura de congelación del agua es de 32° F y la de ebullición es de 212 °F.
•Escalas absolutas: Son las que consideran al cero absoluto como punto de referencia, en el cero absoluto se considera que no existe movimiento molecular
Escala Kelvin: El punto de congelamiento del agua es 273 K y el de ebullición 373 K. Llamada así en honor a su creador, el físico inglés William Kelvin. No lleva el símbolo de grados °
Escala Rankine: El punto de congelamiento del agua es 492 ° R
EL ÁTOMO
En la filosofía de la antigua Grecia, la palabra “átomo” se empleaba para referirse a la parte de materia más pequeño que podía concebirse.
En el siglo V antes de Cristo, el filósofo griego Demócrito postuló, sin evidencia científica, que el Universo estaba compuesto por partículas muy pequeñas e indivisibles, que llamó "átomos".
A esta especulación se le llamó Atomismo, la cual hablaba de la existencia de átomos indestructibles e indivisibles

El Modelo de DALTON (1808)
Modelo de RutherfordSir Ernst Rutherford (1871 - 1937), famoso hombre de ciencia inglés que obtuvo el premio Nobel de Química en 1919, fue un físico neerlandés que identificó en 1898 dos tipos de las radiaciones emitidas por el Uranio, a las que llamó alfa y beta.
Modelo de Bohr
Modelo cuántico
Con los avances científicos y la aparición de la ciencia experimental se ha demostrado que la estructura atómica integra a partículas más pequeñas.

El Modelo de DALTON (1808)
John Dalton (1766-1844) fue un químico y físico británico que creó una importante teoría atómica de la materia basada en las leyes de la combinación química. Considerado el padre de la teoría atómica – molecular. Para Dalton los átomos eran esferas rígidas. Su teoría se puede resumir así:
•Los elementos químicos están formados por partículas muy pequeñas e indivisibles llamadas átomos.
•Todos los átomos de un elemento químico dado son idénticos en su masa y demás propiedades.
•Los átomos de diferentes elementos químicos son distintos, en particular sus masas son diferentes.
•Los átomos son indestructibles y retienen su identidad en los cambios químicos.
•Los compuestos se forman cuando átomos de diferentes elementos se combinan entre sí, en una relación de números enteros sencilla, formando entidades definidas (hoy llamadas moléculas).
Modelo de Thomson
Sir Joseph John Thomson (1856 -1940), fue un físico británico que descubrió la existencia del ELECTRÓN, partícula subatómica cargada negativamente. Según el modelo de Thomson, conocido como "modelo del pastel de pasas", el átomo consistía en una esfera uniforme de materia cargada positiva mente en la que se hallaban incrustados los electrones de un modo parecido a como lo están las semillas en una sandía (patilla). Este sencillo modelo explicaba el hecho de que la materia fuese eléctrica mente neutra, pues en los átomos de Thomson la carga positiva era neutralizada por la negativa.
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas: una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella
Modelo de RutherfordSir Ernst Rutherford (1871 - 1937), famoso hombre de ciencia inglés que obtuvo el premio Nobel de Química en 1919, fue un físico neerlandés que identificó en 1898 dos tipos de las radiaciones emitidas por el Uranio, a las que llamó alfa y beta.
El hecho de que sólo unas pocas radiaciones sufriesen desviaciones hizo suponer que las cargas positivas que las desviaban estaban concentradas dentro de los átomos ocupando un espacio muy pequeño en comparación a todo el tamaño atómico; esta parte del átomo con electricidad positiva fue llamado NÚCLEO.
En el modelo de Rutherford, los electrones se movían alrededor del núcleo como los planetas alrededor del Sol. La carga eléctrica del núcleo y de los electrones se neutralizan entre sí, provocando que el átomo sea eléctrica mente neutro. Los electrones no caían en el núcleo, ya que la fuerza de atracción electrostática era contrarrestada por la tendencia del electrón a continuar moviéndose en línea recta. Este modelo fue satisfactorio hasta que se observó que estaba en contradicción con una información ya conocida en aquel momento: de acuerdo con las leyes del electromagnetismo, un electrón o todo objeto eléctrica mente cargado que es acelerado o cuya dirección lineal es modificada, emite o absorbe radiación electromagnética.
Después de los descubrimientos de Rutherford, los científicos pensaron en el átomo como un sistema solar microscópico, con los electrones girando en órbita alrededor del núcleo, Bohr al principio supuso que los electrones se movían en órbitas circulares, pero la física clásica decía que una partícula con carga eléctrica debía perder energía, lo que llevaría en un momento hacer al electrón caer hacia el núcleo, entonces Bohr dijo que las leyes conocidas de la física eran inadecuadas para describir algunos procesos de los átomos. El físico Danés Niels Bohr, premio Nobel de Física en 1922, introdujo en 1913 los tres postulados siguientes:
Primer Postulado: El producto del impulso o cantidad de movimiento (mv) del electrón por la longitud de la órbita que describe es un múltiplo del cuanto de energía (primer postulado).
Segundo Postulado: Mientras un electrón gira en una orbita fija no emite energía radiante.
Tercer Postulado: Un electrón puede saltar desde una orbita de energía a otra inferior de menor energía. En este salto el átomo emite una cantidad de energía radiante igual a la diferencia de energía de los estados inicial y final.
Aunque la teoría de Bohr fue de gran utilidad, tenía fallas, para empezar años después el electrón se identificó con un comportamiento de onda y en este modelo eso no se tomó en cuenta, además el modelo solo funcionaba para el hidrógeno, dejando fuera las relaciones electrón - electrón en átomos de muchos electrones.
El físico E. Schrödinger estableció el modelo mecano-cuántico del átomo, ya que el modelo de Bohr suponía que los electrones se encontraban en órbitas concretas a distancias definidas del núcleo; mientras que, el nuevo modelo establece que los electrones se encuentran alrededor del núcleo ocupando posiciones más o menos probables, pero su posición no se puede predecir con exactitud.Con estas dos partículas, se intentó construir todos los átomos conocidos, pero no pudo ser así porque faltaban unas de las partículas elementales del núcleo que fue descubierto por J. Chadwick en 1932 y que se llamó neutrón. Esta partícula era de carga nula y su masa es ligeramente superior a la del protón (1,6748210-27kg.). Sin negar el considerable avance que supuso la teoría atómica de Bohr, ésta solo podía aplicarse a átomos muy sencillos, y aunque dedujo el valor de algunas constantes, que prácticamente coincidían con los valores experimentales sencillos, el modelo no fue capaz de explicar los numerosos saltos electrónicos, responsables de las líneas que aparecen en los espectros de los átomos que poseen más de un electrón. Al modelo de Bohr se le fueron introduciendo mejoras, pero la idea de un átomo compuesto por orbitas alrededor de un núcleo central puede considerarse demasiado sencilla, no fue posible interpretar satisfactoriamente el espectro de otros átomos con más de un electrón (átomos poli electrónicos) ni mucho menos la capacidad de los átomos para formar enlaces químicos.


ÁTOMO Y MOLÉCULA


ION: CATION Y ANIÓN
Se define al ion como un átomo o una molécula cargados eléctrica mente, debido a que ha ganado o perdido electrones de su dotación normal, lo que se conoce como ionización.
Los iones cargados negativamente, producidos por la ganancia de electrones, se conocen como aniones y los cargados positivamente, consecuencia de una pérdida de electrones, se conocen como cationes.
Un catión es un ion (sea átomo o molécula) con carga eléctrica positiva, esto es, con defecto de electrones. Los cationes se describen con un estado de oxidación positivo.
Un anión es un ion (sea átomo o molécula) con carga eléctrica negativa, esto es, con exceso de electrones. Los aniones se describen con un estado de oxidación negativo.

1) NÚMERO CUÁNTICO PRINCIPAL (n)
Representa los niveles energéticos. Se designa con números enteros positivos desde n=1 hasta n=7 para los elementos conocidos.
2) NÚMERO CUÁNTICO SECUNDARIO O AZIMUTAL ( l )
Determina el subnivel y se relaciona con la forma del orbital.
Cada nivel energético ( n ) tiene "n" subniveles.
3) NÚMERO CUÁNTICO MAGNÉTICO (m)
Representa los orbitales presentes en un subnivel.
4) NÚMERO CUÁNTICO POR SPIN (s)
Se relaciona con el giro del electrón sobre su propio eje. Al estar juntos en un mismo orbital, un electrón gira hacia la derecha y otro hacia la izquierda. Se le asignan números fraccionarios: -1/2 y +1/2

Los iones cargados negativamente, producidos por la ganancia de electrones, se conocen como aniones y los cargados positivamente, consecuencia de una pérdida de electrones, se conocen como cationes.
Un catión es un ion (sea átomo o molécula) con carga eléctrica positiva, esto es, con defecto de electrones. Los cationes se describen con un estado de oxidación positivo.
Un anión es un ion (sea átomo o molécula) con carga eléctrica negativa, esto es, con exceso de electrones. Los aniones se describen con un estado de oxidación negativo.
ION +
Mayor cantidad de portones en relación a los electrones
ÁTOMO
NEUTRO
Igual cantidad de protones y electrones
ION –
Mayor cantidad de electrones en relación a los protones
NÚMERO ATÓMICO Y MASA ATÓMICA DE LOS ELEMENTOS
La masa atómica o número másico
La masa atómica es la cantidad de materia que tiene un átomo y generalmente se obtiene de sumar Z + N = A
Z= el número de protones
N= el número de neutrones
A= masa atómica
El número atómico:
El número atómico es el número entero positivo que equivale al número total de protones en un núcleo del átomo. Se suele representar con la letra Z. Es característico de cada elemento químico y representa una propiedad fundamental del átomo. Este hecho permitió clasificar a los elementos en la tabla periódica en orden creciente de número atómico.
MOLÉCULA:
Es un conjunto de átomos unidos unos con otros por enlaces fuertes. Es la expresión mínima de un compuesto o sustancia química, es decir, es una sustancia química constituida por la unión de varios átomos que mantienen las propiedades químicas específicas de la sustancia que forman.
Una macromolécula puede estar constituida por miles o hasta millones de átomos, típicamente enlazados en largas cadenas.
Cada molécula tiene un tamaño definido y puede contener los átomos del mismo elemento o los átomos de diversos elementos.
Una sustancia que está compuesta por moléculas que tienen dos o más elementos químicos, se llama compuesto químico.
CONFIGURACIÓN ELECTRÓNICA
La configuración electrónica de un átomo es una designación de la distribución de los electrones entre los diferentes orbitales, en las capas principales y las subcapas. La notación de la configuración electrónica utiliza los símbolos de subcapa (s, p, d y f) y cada uno con un superíndice que indica el número de electrones en ese subnivel.
Por ejemplo para el Li el cual tiene 3 electrones sería, 1s2 2s1; el número que se encuentra al lado de la subcapa es n, la letra representa el subnivel y el superíndice el número de electrones en ese subnivel.

Tipos de configuración electrónica
Para graficar la configuración electrónica existen cuatro modalidades, con mayor o menor complejidad de comprensión, que son:
Configuración estándar: Se representa la configuración electrónica que se obtiene usando el cuadro de las diagonales. Es importante recordar que los orbitales se van llenando en el orden en que aparecen, siguiendo esas diagonales, empezando siempre por el 1s.
Aplicando el mencionado cuadro de las diagonales la configuración electrónica estándar, para cualquier átomo, es la siguiente:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Configuración condensada: Los niveles que aparecen llenos en la configuración estándar se pueden representar con un gas noble (elemento del grupo VIII), donde el número atómico del gas coincida con el número de electrones que llenaron el último nivel. Los gases nobles son He, Ne, Ar, Kr, Xe y Rn.
Configuración desarrollada: Consiste en representar todos los electrones de un átomo empleando flechas para simbolizar el spin de cada uno. El llenado se realiza respetando el principio de exclusión de Pauli y la Regla de máxima multiplicidad de Hund.
Configuración semidesarrollada: Esta representación es una combinación entre la configuración condensada y la configuración desarrollada. En ella sólo se representan los electrones del último nivel de energía.
NÚMEROS CUÁNTICOS
1) NÚMERO CUÁNTICO PRINCIPAL (n)
Representa los niveles energéticos. Se designa con números enteros positivos desde n=1 hasta n=7 para los elementos conocidos.
2) NÚMERO CUÁNTICO SECUNDARIO O AZIMUTAL ( l )
Determina el subnivel y se relaciona con la forma del orbital.
Cada nivel energético ( n ) tiene "n" subniveles.
3) NÚMERO CUÁNTICO MAGNÉTICO (m)
Representa los orbitales presentes en un subnivel.
4) NÚMERO CUÁNTICO POR SPIN (s)
Se relaciona con el giro del electrón sobre su propio eje. Al estar juntos en un mismo orbital, un electrón gira hacia la derecha y otro hacia la izquierda. Se le asignan números fraccionarios: -1/2 y +1/2
TABLA PERIÓDICA DE LOS ELEMENTOS

Tabla Periódica de Elementos Químicos.
La Tabla Periódica de Elementos Químicos clasifica, organiza y distribuye los distintos elementos químicos, conforme a sus propiedades y características. La misma se le atribuye al químico ruso Dimitri Ivanovich Mendeléiev, quien ordenó los elementos basándose en la variación manual de las propiedades químicas, si bien Jullius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. La forma actual es una versión modificada de la de Mendeléiev, fue diseñada por Alfred Werner.
Descripción: Los elementos se hallan distribuidos:
•En 7 filas denominadas (periodos).
•En 18 columnas o familias, las cuales se ordenan en grupos; 8 grupos A y 8 grupos B.
PERIODOS: Son las filas horizontales, nos indican el último nivel de energía del elemento. Existen 7 periodos o niveles.
•Periodo 1, 2 y 3, formados por 2, 8 y 8 elementos respectivamente, son denominadosPeriodos cortos.
Periodos 4, 5 y 6 son los Periodos largos, el 7º periodo se halla incompleto.
CLASIFICACIÓN DE LAVOISIER
El propio Lavoisier dio la primera clasificación de elementos agrupando los mismos en: Metales, no metales y metaloides o metales de transición

Metales


METALES EN LA TABLA PERIÓDICA


NO METALES
•Propiedades Físicas
•El C, I y S, son sólidos a temperatura ambiente.
•El Br es el único no metal que es líquido a temperatura ambiente
•Tienen puntos de fusión muy bajos y baja densidad
•Características
•Los átomos de los no metales, generalmente gana o comparten electrones
•Son malos conductores del calor y la electricidad

Metaloides

son las uniones entre átomos para formar moléculas. Siempre que existe una molécula es porque ésta es más estable que los átomos que la forman por separado. A la diferencia de energía entre estos dos estados se le denomina energía de enlace.
Generalmente, los átomos se combinan en proporciones fijas para dar moléculas. Por ejemplo, dos átomos de hidrógeno se combinan con uno de oxígeno para dar una molécula de agua. Esta proporción fija se conoce como estequiometria.


















No hay comentarios:
Publicar un comentario