Química orgánica
La química orgánica o química del carbono es
la rama de la química que estudia una clase numerosa de moléculas que
contienen carbono formando
enlaces convalentes carbono - carbono o carbono - hidrógeno y otros ,
también conocidos como compuestos orgánicos . Friedrich Wöhler es conocido como el padre
de la química orgánica
Historia de la química orgánica
La química orgánica se constituyó como disciplina en los años treinta. El desarrollo de nuevos métodos de análisis de las sustancias de origen animal y vegetal, basados en el empleo de disolventes como el éter o el alcohol, permitió el aislamiento de un gran número de sustancias orgánicas que recibieron el nombre de "principios inmediatos". La aparición de la química orgánica se asocia a menudo al descubrimiento, en 1828, por el químico alemán Friedrich Wöhler, de que la sustancia inorgánica cianato de amonio podía convertirse en urea, una sustancia orgánica que se encuentra en la orina de muchos animales. Antes de este descubrimiento, los químicos creían que para sintetizar sustancias orgánicas, era necesaria la intervención de lo que llamaban ‘la fuerza vital’, es decir, los organismos vivos. El experimento de Wöhler rompió la barrera entre sustancias orgánicas e inorgánicas. Los químicos modernos consideran compuestos orgánicos a aquellos que contienen carbono e hidrógeno, y otros elementos (que pueden ser uno o más), siendo los más comunes: oxígeno, nitrógeno, azufre y los halógenos.
En 1856 Sir William Henry Perkin, mientras trataba de estudiar la quinina, accidentalmente fabricó el primer coloranteorgánico ahora conocido como malva de Perkin. Este descubrimiento aumentó mucho el interés industrial por la química orgánica.
La diferencia entre la química orgánica y la química biológica es que en la química biológica las moléculas de ADNtienen una historia y, por ende, en su estructura nos hablan de su historia, del pasado en el que se han constituido, mientras que una molécula orgánica, creada hoy, es sólo testigo de su presente, sin pasado y sin evolución histórica



ORGÁNICOS E INORGÁNICOS
COMPUESTOS ORGÁNICOS
•Esta formado principalmente por : C, H, O, N
•El numero de compuestos orgánicos excede considerablemente al número de compuestos inorgánicos .
•Entre los compuestos orgánicos prevalece el enlace covalente.
•Los compuestos orgánicos son generalmente insolubles en agua debido a su baja polaridad.
•Los compuestos orgánicos son sensibles al calor, es decir, se descomponen fácilmente.
•Los cuerpos orgánicos reaccionan entre si lentamente debido al enlace covalente.
•Las sustancias orgánicas al disolverse no se ionizan, por lo tanto sus moléculas no conducen a la electricidad.
•Los cuerpos orgánicos son inestables aún a bajas temperaturas frente al calor y la luz.
COMPUESTOS INORGÁNICOS
Están constituidos por átomo de cualquier elemento.Resisten a la acción del calor.Los compuestos inorgánicos prevalece el enlace ionico. Los compuestos inorgánicos son solubles al agua debido a su elevada polaridad
•pero insolubles en disolventes orgánicos.
•Los compuestos cuando se encuentran en solución son buenos conductores del calor y la electricidad.
•Los compuestos inorgánicos poseen reacciones instantáneas.
•Las moléculas inorgánicas son menos complejas que los compuestos de carbono, debido a su bajo peso molecular.
•Los compuestos inorgánicos son estables a las condiciones de temperaturas altas.
Los principales grupos funcionales son los siguientes
Grupo hidroxilo (– OH)Es característico de los alcoholes, compuestos constituidos por la unión de dicho grupo a un hidrocarburo (enlace sencillo). Grupo alcoxi (R - O - R)Grupo funcional del tipo R-O-R', en donde R y R' son grupos que contienen átomos de carbono, estando el átomo de oxígeno en medio de ellos, característico de los éteres (enlace sencillo). (Se usa la R ya que estos grupos de átomos constituyen los llamados RADICALESGrupo carbonilo (>C=O)Su presencia en una cadena hidrocarbonada (R) puede dar lugar a dos tipos diferentes de sustancias orgánicas: los aldehídos y las cetonas.En los aldehídos el grupo C=O está unido por un lado a un carbono terminal de una cadena hidrocarbonada (R) y por el otro, a un átomo de hidrógeno que ocupa una posición extrema en la cadena. (R–C=O–H) (enlace doble).En las cetonas, por el contrario, el grupo carbonilo se une a dos cadenas hidrocarbonadas, ocupando por tanto una situación intermedia. (R–C=O–R) (enlace doble).

Masa atómica: masa atómica(m. a.), es la suma de sus protones y neutrones y varía en los distintos elementos de la tabla periódica.Masa molecular: Se calcula sumando las masas atómicas de los elementos que componen la molécula. Así, en el caso del agua: H2O, su masa molecular es: H=2 x 1,00007 + O= 15.9999 = 16 u (Uma)Mol: Un mol es la cantidad de materia que contiene 6,02 x 1023 partículas elementales (ya sea átomos, moléculas, iones, partículas subatómicas, etcétera) en 12 gramos de Carbono. También se llama Número de Avogadro. Por ejemplo, una mol de etanol es igual a 6.023 × 10 23 moléculas de etanol.
CALCULO DE LA MASA MOLECULAR DE UN COMPUESTO, CALCULO DE MOLES
PASOS
PARA CALCULAR MOLES
·
Identifica el compuesto o elemento
que debas convertir a moles.
·
Encuentra el elemento en la tabla
periódica.
·
Anota el peso atómico del
elemento.
·
Multiplica el número de gramos del
elemento/compuesto por la fracción 1/masa molar. Esto es 1 mol dividido por los
pesos atómicos que acabas de obtener. Puedes expresar esto como una fracción
del número de gramos por 1 mol dividido por la masa molar, o “compuesto g x 1/masa
molar (g/mol) = moles”.
· Divide ese número por la masa
molar. El resultado es el número de moles de tu elemento o compuesto.
¿Cuántas moles de hierro representan 25.0 g de hierro (Fe)?
Necesitamos convertir gramos de Fe a moles de Fe. Buscamos la masa atómica del Fe y vemos que es 55.85 g . Utilizamos el factor de conversión apropiado para obtener moles.

¿Cuántos átomos de magnesio están contenidos en 5.00 g de magnesio (Mg)?
Necesitamos convertir gramos de Mg a átomos de Mg. Para este factor de conversión necesitamos la masa atómica que es 24.31 g.

FORMULA EMPÍRICA Y MOLECULAR

reacciones químicas
Una reacción química, cambio químico o fenómeno químico, es todo proceso termodinámico en el cual una o más sustancias (llamadas reactantes), por efecto de un factor energético, se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con elhierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
A la representación simbólica de las reacciones se les denomina ecuaciones químicas.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, lacarga eléctrica y la masa total.
BALANCEO DE ECUACIONES QUÍMICAS
Una reacción química es la manifestación de un cambio en la materia y la representación de un fenómeno químico. A su expresión escrita se le da el nombre de ecuación química, en la cual se expresa los reactivos a la izquierda y los productos de la reacción a la derecha, ambos separados por una flecha.
Más exactamente, a la izquierda del símbolo indicamos el contenido inicial del sistema en reacción (reactivos), y a la derecha el contenido del sistema final (productos). Cada sustancia se representa por su fórmula química, y posteriormente debemos ajustar toda la ecuación.
Para equilibrar o balancear ecuaciones químicas, existen diversos métodos. En todos, el objetivo que se persigue es que la ecuación química cumpla con la ley de la conservación de la materia.
BALANCEO POR TANTEO
Para balancear por este o todos los demás métodos es necesario conocer la Ley de la conservación de la materia, propuesta por Lavoisier en 1774. Dice lo siguiente
"En una reacción química, la masa de los reactantes es igual a la masa de los reactivos" por lo tanto "La materia no se crea ni se destruye, solo se transforma"
Como todo lleva un orden a seguir, éste método resulta más fácil si ordenamos a los elementos de la siguiente manera:
Balancear primero
Metales y/o no metales
Oxígeno
Hidrógenos
De esta manera, nos resulta más fácil, ya que el mayor conflicto que se genera durante el balanceo es causado principalmente por los oxígenos e hidrógenos.
Balancear por el método de tanteo consiste en colocar números grandes denominados "Coeficientes" a la derecha del compuesto o elemento del que se trate. De manera que Tanteando, logremos una equivalencia o igualdad entre los reactivos y los productos.
Ejemplo:
Balancear la siguiente ecuación química:

"En una reacción química, la masa de los reactantes es igual a la masa de los reactivos" por lo tanto "La materia no se crea ni se destruye, solo se transforma"
Como todo lleva un orden a seguir, éste método resulta más fácil si ordenamos a los elementos de la siguiente manera:
Balancear primero
Metales y/o no metales
Oxígeno
Hidrógenos
De esta manera, nos resulta más fácil, ya que el mayor conflicto que se genera durante el balanceo es causado principalmente por los oxígenos e hidrógenos.
Balancear por el método de tanteo consiste en colocar números grandes denominados "Coeficientes" a la derecha del compuesto o elemento del que se trate. De manera que Tanteando, logremos una equivalencia o igualdad entre los reactivos y los productos.
Ejemplo:
Balancear la siguiente ecuación química:

BALANCEO POR EL MÉTODO DE ÓXIDO-REDUCCIÓN
Es también denominado "Redox" y consiste en que un elemento se oxida y (hablar de oxidación se refiere a que un elemento pierda electrones y su valencia aumente) el otro se reduce (cuando el elemento gana electrones y su valencia disminuye) para éste método se siguen los siguientes pasos o reglas:
1. Todos los elementos libres que no formen compuesto, tendrán valencia cero
2. El hidrógeno tendrá valencia de +1 excepto en hidruros con -1
3. El oxígeno tendrá valencia de 2- excepto en los peróxidos con -1
4. Los alcalinos tienen en sus compuestos oxidación +1
5. Los alcalinotérreos tienen en sus compuestos oxidación +2
6. Los alógenos tienen en sus compuestos con aluros oxidación -1
7. La suma de los números de oxidación de todos los átomos de un compuesto es igual a la carga de los compuestos
8. Si algún átomo se oxida su numero de oxidación aumenta y cuando un átomo se reduce, su numero de oxidación disminuye
Ejemplo:
Balancear la siguiente ecuación:
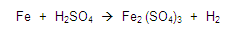
1. Todos los elementos libres que no formen compuesto, tendrán valencia cero
2. El hidrógeno tendrá valencia de +1 excepto en hidruros con -1
3. El oxígeno tendrá valencia de 2- excepto en los peróxidos con -1
4. Los alcalinos tienen en sus compuestos oxidación +1
5. Los alcalinotérreos tienen en sus compuestos oxidación +2
6. Los alógenos tienen en sus compuestos con aluros oxidación -1
7. La suma de los números de oxidación de todos los átomos de un compuesto es igual a la carga de los compuestos
8. Si algún átomo se oxida su numero de oxidación aumenta y cuando un átomo se reduce, su numero de oxidación disminuye
Ejemplo:
Balancear la siguiente ecuación:
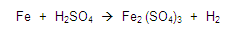
Si vemos la primera regla, esta nos dice que todos los elementos libres tendrán valencia cero, entonces vemos la ecuación y localizamos a los elementos libres, en este caso son el fierro y el hidrógeno, colocamos un cero como valencia.
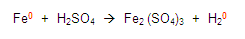
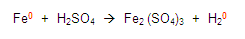
Continuamos con las demás reglas y encontramos a los oxígenos e hidrógenos y les asignamos la valencia que les corresponde, establecidas en las reglas:
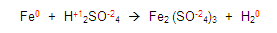
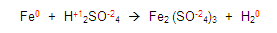
Para continuar, obtenemos la valencia de los elementos que nos sobran, en este caso el azufre y el fierro:
Ubiquémonos en el azufre (S) del primer miembro en la ecuación
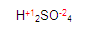
y posteriormente obtendremos la valencia del azufre. Quede claro que la del hidrógeno y la del oxígeno ya la tenemos.
Para obtener la valencia del azufre, simplemente (pon mucha atención aquí) vamos a multiplicar la valencia del oxígeno por el número de oxígenos que hay. (En este caso hay 4 oxígenos) y hacemos lo mismo con el hidrógeno, multiplicamos su valencia por el número de oxígenos que hay. Queda de la siguiente manera
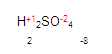
Ya que tenemos los resultados, ahora verificamos que todo elemento químico es eléctricamente neutro y lo comprobamos de la siguiente manera:
Tenemos que llegar a cero. Buscamos cuanto falta de dos para ocho. Entonces encontramos que faltan 6, este número será colocado con signo positivo +
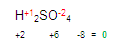
Ubiquémonos en el azufre (S) del primer miembro en la ecuación
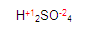
y posteriormente obtendremos la valencia del azufre. Quede claro que la del hidrógeno y la del oxígeno ya la tenemos.
Para obtener la valencia del azufre, simplemente (pon mucha atención aquí) vamos a multiplicar la valencia del oxígeno por el número de oxígenos que hay. (En este caso hay 4 oxígenos) y hacemos lo mismo con el hidrógeno, multiplicamos su valencia por el número de oxígenos que hay. Queda de la siguiente manera
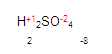
Ya que tenemos los resultados, ahora verificamos que todo elemento químico es eléctricamente neutro y lo comprobamos de la siguiente manera:
Tenemos que llegar a cero. Buscamos cuanto falta de dos para ocho. Entonces encontramos que faltan 6, este número será colocado con signo positivo +
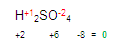
El 6 que acabamos de obtener es la valencia del azufre en el primer miembro.
Ubiquémonos en el fierro del segundo miembro en donde se encuentra el compuesto
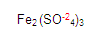
Ubiquémonos en el fierro del segundo miembro en donde se encuentra el compuesto
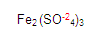
Localizamos al fierro. Para obtener su valencia primero denominamos si es monovalente o divalente etc. Ya que vimos que es divalente, necesitamos saber la valencia del radical sulfato, en este caso es
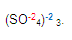
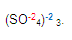
Para obtener la valencia del fierro, multiplicamos la valencia del radical (-2) con el subíndice que se encuentre fuera del mismo
Después lo dividimos entre el número de fierros que hay en el compuesto (en este caso hay dos fierros)
Queda de la siguiente manera:
2 * 3 = 6 6/2 = 3
El tres que acabamos de obtener es la valencia del fierro.
Que nos quede claro, ya tenemos la valencia del fierro que es 3, ya tenemos la valencia del oxígeno que es -2, ahora nos falta la valencia del azufre (S) lo cual realizaremos algo similar con lo dicho con anterioridad:
Multiplicamos la valencia del radical sulfato (-2) con el subíndice (3) y después con el número de oxígenos que hay dentro del paréntesis (4).

Después lo dividimos entre el número de fierros que hay en el compuesto (en este caso hay dos fierros)
Queda de la siguiente manera:
2 * 3 = 6 6/2 = 3
El tres que acabamos de obtener es la valencia del fierro.
Que nos quede claro, ya tenemos la valencia del fierro que es 3, ya tenemos la valencia del oxígeno que es -2, ahora nos falta la valencia del azufre (S) lo cual realizaremos algo similar con lo dicho con anterioridad:
Multiplicamos la valencia del radical sulfato (-2) con el subíndice (3) y después con el número de oxígenos que hay dentro del paréntesis (4).

Obtenemos un total de 24. Este número que resultó se le llama valencia parcial
Después continuamos con el fierro. Ahora ya que tenemos que la valencia del fierro es 3 entonces multiplicamos la valencia por el numero de fierros que hay (hay 2)
Y nos da un resultado de 6.
Entonces:
Tenemos 6 y tenemos -24, de 6 a 24 ¿Cuánto falta?
Respuesta: +18
Ahora el 18 lo dividimos entre el número de azufres que hay: nos da un total de 6 o sea +6.
Y de esta manera ya obtuvimos todas las valencias del compuesto químico:
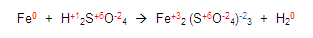
Después continuamos con el fierro. Ahora ya que tenemos que la valencia del fierro es 3 entonces multiplicamos la valencia por el numero de fierros que hay (hay 2)
Y nos da un resultado de 6.
Entonces:
Tenemos 6 y tenemos -24, de 6 a 24 ¿Cuánto falta?
Respuesta: +18
Ahora el 18 lo dividimos entre el número de azufres que hay: nos da un total de 6 o sea +6.
Y de esta manera ya obtuvimos todas las valencias del compuesto químico:
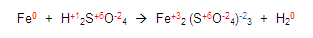
Ahora, vamos a verificar cuál elemento se oxida y cual se reduce, para esto, chequemos las valencias de los elementos, debemos verificar que en los dos miembros estén iguales.
Si vemos al fierro en el primer miembro y luego lo vemos en el segundo. Encontramos que sus valencias ya no son las mismas por tanto el elemento se está oxidando porque aumenta su valencia de cero a 3
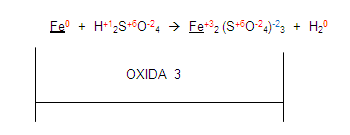
Ahora, si nos fijamos en el hidrógeno del primer miembro, se está reduciendo con el hidrógeno del segundo miembro:
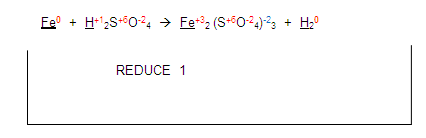
Entonces la ecuación queda de la siguiente manera:
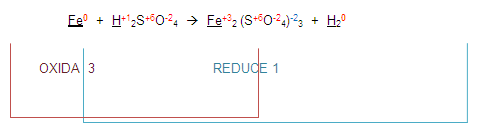
Ahora, para poder completar el balanceo, (atención) vamos a intercambiar los números que se oxidaron o redujeron. Esto es el 3 y el 1.
El 3 lo colocaremos en el lugar del 1 y el 1 en el lugar del 3
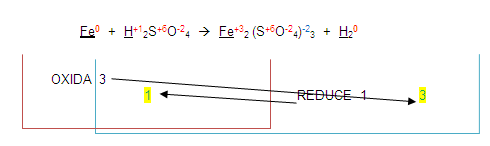
Si vemos al fierro en el primer miembro y luego lo vemos en el segundo. Encontramos que sus valencias ya no son las mismas por tanto el elemento se está oxidando porque aumenta su valencia de cero a 3
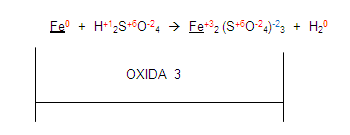
Ahora, si nos fijamos en el hidrógeno del primer miembro, se está reduciendo con el hidrógeno del segundo miembro:
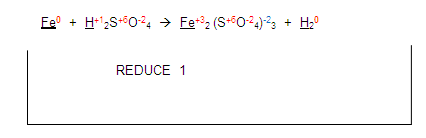
Entonces la ecuación queda de la siguiente manera:
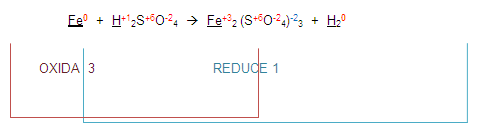
Ahora, para poder completar el balanceo, (atención) vamos a intercambiar los números que se oxidaron o redujeron. Esto es el 3 y el 1.
El 3 lo colocaremos en el lugar del 1 y el 1 en el lugar del 3
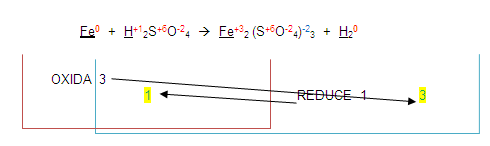
Estos números resultantes se colocan de lado izquierdo de los elementos que se oxidaron o redujeron.
El número 1 (que por lo general no se escribe) se coloca de lado izquierdo del fierro en los dos miembros.
El número 3 se coloca de lado izquierdo del hidrógeno en los dos miembros quedando de la siguiente forma:
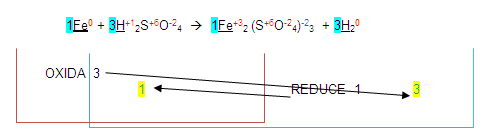
El número 1 (que por lo general no se escribe) se coloca de lado izquierdo del fierro en los dos miembros.
El número 3 se coloca de lado izquierdo del hidrógeno en los dos miembros quedando de la siguiente forma:

Entonces de esta manera podemos deducir que la ecuación está balanceada, pero, no es así, uno de los pasos para terminarla es: "Una vez obtenidos los números de la ecuación, se completará con método de tanteo".
Verificamos si así está balanceada:
1= Fe =2
3 = S = 3
12= O =12
6 = H = 6
Con este insignificante 2 que acabos de encontrar en el fierro del segundo miembro LA ECUACIÓN NO ESTÁ BALANCEADA aunque los demás átomos lo estén.
Completamos por tanteo
En el primer miembro (Fe) hay 1 átomo, en el segundo 2, entonces colocamos un 2 en el primer miembro y…
YA ESTÁ BALANCEADA.
Se siguen los siguientes pasos:
Escribir sobre cada molécula una literal, siguiendo el orden alfabético.
En listar verticalmente los átomos que participan en la reacción
A la derecha del símbolo de cada elemento que participa se escribe el número de veces que el elemento se encentra en cada molécula identificada por letra.
Si de un lado de la reacción un elemento se encuentra en mas de una molécula, se suman y se escribe cuantas veces está presente en una molécula
Se cambia la flecha por un signo igual =
Se enlistan las letras que representan las moléculas y a la letra más frecuente se le asigna el valor de uno
Los valores de las letras se obtienen por operaciones algebraicas
Ejemplo:
Balancear la siguiente ecuación:

Aplicamos el segundo paso:
Ca
C
O
H
Continuamos con el tercer paso:
Ca: (Ca está en "a" del primer miembro y en "c" en el segundo por lo tanto) a=c
C: (C está 2 veces en "a" y 2 veces en "d" por lo tanto) 2a = 2d
O: (O está en "b" y 2 veces en "c" por lo tanto) b = 2c
H: (H está 2 veces en "b", 2 en "c" y 2 veces en "d" por lo tanto) 2b = 2c + 2d
Le asignaremos el valor de "1" a C

La estequiometria es el área de la química que estudia la relación entre las moléculas de reactantes y productos dentro de una reacción química.
Como sabemos, para que se forme un compuesto debe haber una separación, combinación o reordenamiento de los elementos, lo que se puede ilustrar por medio de una reacción, la cual representa el proceso que ocurrió para que un determinado reactante llegara a ser un producto.
Reactantes →Productos
(Louis Joseph Proust 1754-1826). En la formación de un compuesto, la proporción de elemento que se combina con una masa definida de otro elemento, será siempre la misma, es decir, cada compuesto químico, contiene siempre los mismos elementos unidos en idénticas proporciones.
por ejemplo, del cloruro sódico indica que para formar 5 g de cloruro sódico, se necesitan 3 g de cloro y 2 g de sodio, por lo que la proporción entre las masas de ambos elementos es:

Si hacemos reaccionar ahora 10 g de cloro, como se calcular cuántos g de sodio se necesita y cuál es la proporción entre las masas:

LEY DE LAS PROPORCIONES MÚLTIPLES
(Jonh Dalton). "Las cantidades variables de un mismo elemento que se combinan con una cantidad fija de otro para formar dos o más compuestos distintos, se encuentran en una relación numérica sencilla".
Un ejemplo de aplicación de la ley de Dalton es el siguiente: 16 g de oxígeno pueden combinarse con 14 g de nitrógeno para producir monóxido de nitrógeno, o con 7 g de nitrógeno para formar dióxido de nitrógeno. Se obtiene una relación de números enteros sencilla entre las cantidades variables de nitrógeno que se combinan con una misma cantidad de oxígeno. 7:14 = 1:2
REACTIVO LIMITANTE y REACTIVO EN EXCESO
El reactivo limitante es aquel que limita la reacción. Es decir: una vez que este reactivo se acaba, termina la reacción. El reactivo que sobra se llama reactivo excedente. Por lo tanto, la cantidad de producto que se forme depende de la cantidad de reactivo limitante. Este depende de la reacción y es distinto para cada una de ellas.
Por ejemplo: Si debemos hacer sándwich de queso, y para ello disponemos de siete panes y sólo cinco láminas de queso, ¿cuántos sándwiches podré hacer? Sólo podré hacer cinco sándwiches, y por tanto las láminas de queso serán el reactivo limitante de este proceso, mientras que el pan será el reactivo excedente.

REACTIVO LIMITANTE y REACTIVO EN EXCESO

Pasos:
1. Igualar la ecuación
2. Calcular UMA
3. Calcular moles
4. Dividir los moles obtenidos para el coeficiente molar
El compuesto con menor número de moles será el reactivo limitante y el mayor será el reactivo en exceso.
A partir de los moles obtenidos del reactivo limitante, se busca mediante regla de tres el valor de moles del otro reactivo.
Para calcular el exceso se trabaja con los moles del compuesto en exceso menos el valor obtenido de la regla de tres
Para calcular la masa del exceso se multiplica los moles por la UMA
Verificamos si así está balanceada:
1= Fe =2
3 = S = 3
12= O =12
6 = H = 6
Con este insignificante 2 que acabos de encontrar en el fierro del segundo miembro LA ECUACIÓN NO ESTÁ BALANCEADA aunque los demás átomos lo estén.
Completamos por tanteo
En el primer miembro (Fe) hay 1 átomo, en el segundo 2, entonces colocamos un 2 en el primer miembro y…
YA ESTÁ BALANCEADA.
BALANCEO POR EL MÉTODO ALGEBRAICO/MATEMÁTICO
Se siguen los siguientes pasos:
Escribir sobre cada molécula una literal, siguiendo el orden alfabético.
En listar verticalmente los átomos que participan en la reacción
A la derecha del símbolo de cada elemento que participa se escribe el número de veces que el elemento se encentra en cada molécula identificada por letra.
Si de un lado de la reacción un elemento se encuentra en mas de una molécula, se suman y se escribe cuantas veces está presente en una molécula
Se cambia la flecha por un signo igual =
Se enlistan las letras que representan las moléculas y a la letra más frecuente se le asigna el valor de uno
Los valores de las letras se obtienen por operaciones algebraicas
Ejemplo:
Balancear la siguiente ecuación:

Aplicamos el segundo paso:
Ca
C
O
H
Continuamos con el tercer paso:
Ca: (Ca está en "a" del primer miembro y en "c" en el segundo por lo tanto) a=c
C: (C está 2 veces en "a" y 2 veces en "d" por lo tanto) 2a = 2d
O: (O está en "b" y 2 veces en "c" por lo tanto) b = 2c
H: (H está 2 veces en "b", 2 en "c" y 2 veces en "d" por lo tanto) 2b = 2c + 2d
Le asignaremos el valor de "1" a C

ESTEQUIOMETRÍA
La estequiometria es el área de la química que estudia la relación entre las moléculas de reactantes y productos dentro de una reacción química.
Como sabemos, para que se forme un compuesto debe haber una separación, combinación o reordenamiento de los elementos, lo que se puede ilustrar por medio de una reacción, la cual representa el proceso que ocurrió para que un determinado reactante llegara a ser un producto.
Reactantes →Productos
LEY DE LAS PROPORCIONES DEFINIDAS
(Louis Joseph Proust 1754-1826). En la formación de un compuesto, la proporción de elemento que se combina con una masa definida de otro elemento, será siempre la misma, es decir, cada compuesto químico, contiene siempre los mismos elementos unidos en idénticas proporciones.
por ejemplo, del cloruro sódico indica que para formar 5 g de cloruro sódico, se necesitan 3 g de cloro y 2 g de sodio, por lo que la proporción entre las masas de ambos elementos es:

Si hacemos reaccionar ahora 10 g de cloro, como se calcular cuántos g de sodio se necesita y cuál es la proporción entre las masas:

LEY DE LAS PROPORCIONES MÚLTIPLES
(Jonh Dalton). "Las cantidades variables de un mismo elemento que se combinan con una cantidad fija de otro para formar dos o más compuestos distintos, se encuentran en una relación numérica sencilla".
Un ejemplo de aplicación de la ley de Dalton es el siguiente: 16 g de oxígeno pueden combinarse con 14 g de nitrógeno para producir monóxido de nitrógeno, o con 7 g de nitrógeno para formar dióxido de nitrógeno. Se obtiene una relación de números enteros sencilla entre las cantidades variables de nitrógeno que se combinan con una misma cantidad de oxígeno. 7:14 = 1:2
REACTIVO LIMITANTE y REACTIVO EN EXCESO
El reactivo limitante es aquel que limita la reacción. Es decir: una vez que este reactivo se acaba, termina la reacción. El reactivo que sobra se llama reactivo excedente. Por lo tanto, la cantidad de producto que se forme depende de la cantidad de reactivo limitante. Este depende de la reacción y es distinto para cada una de ellas.
Por ejemplo: Si debemos hacer sándwich de queso, y para ello disponemos de siete panes y sólo cinco láminas de queso, ¿cuántos sándwiches podré hacer? Sólo podré hacer cinco sándwiches, y por tanto las láminas de queso serán el reactivo limitante de este proceso, mientras que el pan será el reactivo excedente.

REACTIVO LIMITANTE y REACTIVO EN EXCESO

REACTIVO LIMITANTE Y EN EXCESO
1. Igualar la ecuación
2. Calcular UMA
3. Calcular moles
4. Dividir los moles obtenidos para el coeficiente molar
El compuesto con menor número de moles será el reactivo limitante y el mayor será el reactivo en exceso.
A partir de los moles obtenidos del reactivo limitante, se busca mediante regla de tres el valor de moles del otro reactivo.
Para calcular el exceso se trabaja con los moles del compuesto en exceso menos el valor obtenido de la regla de tres
Para calcular la masa del exceso se multiplica los moles por la UMA
PORCENTAJE DE RENDIMIENTO
Es la cantidad de producto que se obtiene al finalizar una reacción.
Rendimiento experimental (real) x 100
Rendimiento teórico
Rendimiento experimental es el que se obtiene después de un proceso de reacción, que se puede ver afectado por factores como la presión, temperatura, cantidades de reactivos, la pureza, etc.
Rendimiento teórico: se calcula a partir del reactivo limitante.
Rendimiento experimental (real) x 100
Rendimiento teórico
Rendimiento experimental es el que se obtiene después de un proceso de reacción, que se puede ver afectado por factores como la presión, temperatura, cantidades de reactivos, la pureza, etc.
Rendimiento teórico: se calcula a partir del reactivo limitante.
PASOS PARA CALCULAR PORCENTAJE DE RENDIMIENTO.
1. Balancear la reacción
2. Convertir a moles todas las cantidades
3. Determinar el reactivo limitante
4. Calcular el rendimiento teórico
5. Identificar el rendimiento experimental 6. Calcular el porcentaje de rendimiento
Algunas reacciones trabajan con sustancias puras, lo que quiere decir que hay que eliminar las impurezas sobretodo cuando se trata de sustancias minerales.
Con frecuencia en los laboratorios e industrias reactivos que se emplean presentan impurezas y esto afecta la calidad del producto, el cual no se obtendrá en estado puro.
Como las relaciones estequiométricas se basan en sustancias puras es necesario estar seguros de que las cantidades tomadas para los cálculos correspondan a material puro que se encuentra en los reactivos con impurezas.
La cantidad sustancia pura (SP) de una sustancia impura (SI) se puede calcular de la siguiente manera:
SP = (SI x %Pureza)/100
GAS IDEAL
1. Balancear la reacción
2. Convertir a moles todas las cantidades
3. Determinar el reactivo limitante
4. Calcular el rendimiento teórico
5. Identificar el rendimiento experimental 6. Calcular el porcentaje de rendimiento
% PUREZA
Algunas reacciones trabajan con sustancias puras, lo que quiere decir que hay que eliminar las impurezas sobretodo cuando se trata de sustancias minerales.
Con frecuencia en los laboratorios e industrias reactivos que se emplean presentan impurezas y esto afecta la calidad del producto, el cual no se obtendrá en estado puro.
Como las relaciones estequiométricas se basan en sustancias puras es necesario estar seguros de que las cantidades tomadas para los cálculos correspondan a material puro que se encuentra en los reactivos con impurezas.
La cantidad sustancia pura (SP) de una sustancia impura (SI) se puede calcular de la siguiente manera:
SP = (SI x %Pureza)/100
GAS IDEAL
Es aquel que cumple exactamente con las leyes establecidas para los gases, es decir, un gas donde no hay fuerzas de atracción o repulsión entre las moléculas y el cual el volumen real de las moléculas es insignificante.
LEYES DE LOS GASES
Las principales leyes que rigen el estado gaseoso son:
a)Ley de Boyle – Mariotte
b)Ley de Jacques Charles I y II
c)Ley de Gay Lussac
d)Ley Combinada – Ecuación general
e)Ley de Dalton
a)Ley de Boyle – Mariotte
b)Ley de Jacques Charles I y II
c)Ley de Gay Lussac
d)Ley Combinada – Ecuación general
e)Ley de Dalton
Cumple exactamente con las leyes establecidas para los gases, un gas donde no hay fuerzas de atracción o repulsión entre las moléculas.
LEY DE LOS GASES
a) Ley de Boyle – Mariotte
b) Ley de Jacques Charles I y II
c) Ley de Gay Lussac
d) Ley Combinada – Ecuación general
e) Ley de Dalton
Ley Combinada: P1 * P1/ T1 = P2 * v2/T2
Presión: P
Temperatura: (P)
Volumen :(V)
LEY DE BOYLE – MARIOTTE
“Si la presión aumenta, el volumen disminuye.”
Un volumen de Hidrógeno igual a 750 ml están a 17°C. Si el volumen ha cambiado a 982 ml. Cuál fue la temperatura que actúo suponiendo que la presión no varía.
LEY DE CHARLES I
Si la temperatura aumenta, el volumen aumenta.
Cuando la presión se mantiene constante, los volúmenes de los gases son directamente proporcionales a las temperaturas ABSOLUTAS.
LEY DE GAY LUSSAC
Si la temperatura aumenta, la presión también aumenta.
El volumen se mantiene constante, las presiones que ejercen los gases son directamente proporcionales a sus temperaturas ABSOLUTAS

Combinando las 3 leyes estudiadas: Boyle, Charles y Gay Lussac, se tiene la ley combinada.
SOLUCIONES

ECUACIÓN GENERAL
P = presión
V = volumen
N = número de moles = Pa = (Peso en gramos del gas)
Ma (Peso molecular del gas)
T = Temperatura en grados Kelvin
R = Constante universal de los gases = 0.082 at – li
mol . K


LEY DE DALTON
“La presión total de una mezcla de dos o más gases que no reaccionan entre sí es igual a la suma de las presiones de los componentes”
Ejercicio 20:
Si un litro de nitrógeno encerrado en un recipiente ejerce una presión de 80 torr y un litro de oxígeno contenido en otro recipiente ejerce una presión de 30 torr. Cuál es la presión si se mezclan en un recipiente de un volumen total de un litro.
SOLUCIÓN:
Se denomina así a la mezcla de dos o más componentes en cantidades fijas o no, que forman un todo homogéneo, esto es, que no existan zonas de separación o fases.

Las soluciones se clasifican:
Diluidas: Son aquellas en las que hay muy poca cantidad de soluto disuelto, el solventepuede seguir admitiendo más soluto. Un ejemplo es la cantidad de minerales en el agua de mesa: tiene una cantidad muy baja que nos permite asimilarlos correctamente.
Concentradas: Son aquellas en las que hay bastante cantidad de soluto disuelto, pero el solvente todavía puede seguir admitiendo más soluto. Un ejemplo podría ser el agua de mar: contiene una gran cantidad de sal disuelta, pero todavía sería posible disolver más cantidad de sal.
Las soluciones se clasifican:

ejemplos de solución
CONCENTRACIONES
La concentración de las soluciones es la cantidad de soluto contenido en una cantidad determinada de solvente o solución. Los términos diluidos o concentrados expresan concentraciones relativas. Para expresar con exactitud la concentración de las soluciones se usan sistemas como los siguientes:
a)Porcentaje peso a peso (% M/M): indica el peso de soluto por cada 100 unidades de peso de la solución.

b) Porcentaje volumen a volumen (% V/V): se refiere al volumen de soluto por cada 100 unidades de volumen de la solución.

c) Porcentaje peso a volumen (% P/V): indica el número de gramos de soluto que hay en cada 100 ml de solución.

SOLUCIÓN NORMAL O NORMALIDAD (SOL. N, N)
*Son soluciones que contienen un equivalente químico del soluto en un volumen de 1000ml (1 L)
*El equivalente químico (Eq) se calcula dividiendo el peso molecular (Ma) del soluto expresado en gramos para la valencia.
Sol. N = Eq en 1000 ml
Eq de H2SO4 = peso molecular 98 gramos
Eq = 98 gr = 49 gr
2
SOLUCIÓN MOLAR O MOLARIDAD
Solución molar (Sol. M) es aquella que tiene disuelto una mol del soluto (peso molecular del solvente en gramos) disuelto en un volumen total de 1000 ml
Sol. M = Ma en 1000 ml
A diferencia de la normalidad, en la molaridad no se divide para la valencia.
Se derivan las siguientes fórmulas para este tipo de soluciones:
Pa= M x V x Ma M = Pa x 1000 ml
1000 ml V x Ma
V= Pa x 1000 ml Ma = Pa x 1000 ml
M x Ma M x V
MOLALIDAD
Una solución molal (Sol. m) es aquella que contiene una mol de soluto «más» 1000 gramos de solvente.
Pa
m= Ma Pa= m x Pb x Ma
Pb (Kg)
Pb= peso del solvente en Kg
FRACCIÓN MOLAR
Es una unidad química usada para expresar la concentración de soluto en solvente.Nos expresa la proporción en que se encuentran los moles de soluto con respecto a los moles totales de solución.
Se representa con la letra X
No tiene unidades
*
1. Xsto = MOLES DE SOLUTO
MOLES DE SOLUTO + MOLES DE DISOLVENTE
2. Xste = MOLES DE SOLUTO
MOLES DE SOLUTO + MOLES DE DISOLVENTE
3. Xsto + Xste = 1


No hay comentarios:
Publicar un comentario